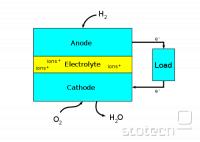
preprosta gorivna celica
vir: WikipediaPri oksidaciji (gorenju) goriva nastajajo toplotna energija, voda in ostali produkti, odvisni od vrste goriva. V gorivnih celicah pa se s pomočjo katalizatorjev kemične reakcije izvajajo nadzorovano, pri njih pa poleg toplotne energije nastaja tudi električna energija. Gorivne celice se med seboj razlikujejo po tem s kakšnim gorivom jih napajamo (ponavadi vodik), pri kakšnem tlaku ali temperaturi obratujejo, vrsti katalizatorja in drugo. Skupno pa jim je to, da so sestavljene iz anode, katode in elektrolita med njima. Na anodi se s pomočjo katalizatorja oksidira gorivo, iz katerega se sprostijo pozitivno nabiti protoni in negativni elektroni. Elektrolit je sestavljen tako, da skozi njega lahko prehajajo le protoni, prosti elektroni pa gredo skozi žico, kjer povzročajo električni tok. Na katodni strani se protoni in elektroni zopet združijo in reagirajo z drugo molekulo (ponavadi kisik) in nastane voda.
Pri razvoju gorivnih celic se raziskovalci soočajo predvsem s problemi optimizacije kinetike katalize in z dolgoročno stabilnostjo katalizatorjev pri ekstremnih elektrokemičnih pogojih. Pri določenih pogojih je stabilnost katode močno omejena zaradi neželjene reakcije s kisikom na anodni strani. Tako predstavlja velik izziv kako omejiti reakcije s kisikom, a ohraniti oksidacijo vodika. Kot trdijo na kemijskem inštitutu sta Genorio in Strmčnik s sodelavci pokazala, da se da ta problem uspešno rešiti z novim pristopom - funkcionalizacijo katalizatorja z organskimi molekulami.
