vir: BBC
Alzheimerjeva bolezen je usodna in neozdravljiva nevrodegenerativna bolezen, ki je tudi glavni povzročitelj demence. Razloga za nastanek bolezni še ne poznamo, dejavniki tveganja za razvoj pa so tako okoljski kakor genetski. Ko bolezen napreduje, se v možganih začno nabirati netopni skupki proteina amiloid beta, ki so nevronom škodljivi in povzročajo njihovo propadanje. Ko bolezen napreduje, se pri posamezniku zmanjšujejo kognitivne funkcije, kar naposled vodi do odpovedi telesnih funkcij, ki jih nadzorujejo možgani, in smrti. Začne pa se nedolžno, z majhnimi težavami pri spominjanju nedavnih dogodkov. Za zdaj ni znanega zdravila, ki bi bolezen ustavil.
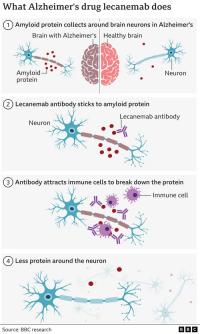
Do lanske odobritve podobnega zdravila aducanemab, o katerem več v nadaljevanju, v ZDA zadnji dve desetletji ni bilo odobrenega nobenega novega zdravila proti Alzheimerjevi bolezni. Lecanemab je novo eksperimentalno zdravilo, ki sodi med monoklonska protitelesa. To so protitelesa, ki nastanejo iz ene celične linije in se vsa vežejo na isti antigen. Poenostavljeno povedano torej prepoznavajo istega vsiljivca na enak način. Protitelesa so namreč eden izmed ključnih delov človeškega imunskega sistema, ki začno nastajati ob vdoru vsiljivca, in so vsakokrat prilagojena tako, da se vežejo točno nanj. Protitelesa pa seveda izdelujejo tudi živali, če jih izpostavimo antigenu. V moderni biokemiji in biomedicini je proizvodnja protiteles proti poljubni snovi praktično rutinska, saj se uporabljajo tako v medicinske kakor povsem diagnostične in biokemične namene, na primer v analizah.
Lecanemab je torej monoklonsko protitelo, ki se veže na protofibrile amiloida beta, kakor imenujemo prve, najmanjše netopne skupke tega proteina, ki se sčasoma sprimejo v večje. V kliničnem preizkusu, o katerem sedaj poročajo, je sodelovalo 1795 ljudi v starosti od 50 do 90 let. Od tega jih je polovica prejemala lecanemab, polovica pa placebo. Po 12 mesecih bistvenih razlik ni bilo, po 18 mesecih pa so jih že opazili (to bo pomembno v nadaljevanju). Skupina, ki je prejemala zdravilo, je izkazovala 27 odstotkov nižji kognitivni upad in manj skupkov v možganih. To so zelo obetavni rezultati, na podlagi katerih sta proizvajalca pri FDA vložila zahtevek za hitro registracijo novega zdravila. To sicer ne pomeni, da zdravilo zdravi Alzheimerjevo bolezen, jo pa vsaj spočetka upočasnjuje.
Ob tem se poraja nekaj vprašanj, na katere odgovora še ni. Prvo vprašanje je seveda, kaj točno pomeni 27 odstotkov počasnejši upad kognitivnih sposobnosti. Bodo ti ljudje zbolevali počasneje? Bodo imeli več svetlih dni? Drugo zelo pomembno vprašanje prinašajo ostala zdravila, ki niso bila uspešna. Lecanemab še zdaleč ni prvi poizkus zdraviti Alzheimerjevo bolezen s protitelesi, ki bi se vezala na skupke amiloida beta in jih po možnosti raztapljala, a so bila doslej ostala neuspešna. Ena izmed možnih razlag je v velikosti skupkov, saj se lecanemab očitno veže na protofibrile, torej najmanjše možne skupke, ki še ne povzročajo veliko težav, medtem ko so ostala neuspešno napadala večje skupke. Zdi se logično - čim prej napademo bolezen, tem bolje se bo zdravljenje izteklo. Od tod do naslednjega vprašanje je le pol koraka: ali deluje lecanemab tudi preventivno? Ga lahko ogroženi posamezniki oziroma bolniki z neznatnimi simptom jemljejo in s tem preprečijo nastanek oziroma razvoj bolezni? Spomnimo se, da ostala zdravila v krajših kliničnih preizkusih niso izkazovala učinkov, podobno kot tudi lecanemab po 12 mesecih ne. Morda je razvoj bolezni preprosto tako počasen ali pa izboljšanje tako neznatno, da se zdravljenje pozna šele po daljšem času. Druga razlika je tudi bolj raznolika struktura bolnikov v tem kliničnem preizkusu, saj se ni omejilo le na belce.
Ob tem ne moremo spregledati nekaj smrti. Lecanemab je protitelo proti proteinu, ki se pri ljudeh pojavlja naravno, in ima tudi zato lahko resne stranske učinke. Pred tremi dnevi smo izvedeli za drugo smrtno žrtev preizkušanja lecanemaba. Zaradi kapi, otekanja in krvavitev, ki so tipične za zdravljenje s protitelesi proti amiloidu beta, je umrla 65-letna udeleženka kliničnega preizkusa. Kakor prva žrtev je imela nediagnosticirano komplikacijo, in sicer amiloidne skupke v okolici žil v možganih. To je sorazmerno pogost zaplet pri bolnikih z Alzheimerjevo boleznijo, redkeje pa se pojavlja pri zdravih ljudeh. Ker sam po sebi ne povzroča simptomov, ga navadno odkrijejo pri obdukciji. Za zdaj kaže, da je bila smrt nedvomno posledica zdravila in da ni šlo za slučaj. Prva žrtev je bil moški, ki je bil star med 80 in 90 ter je umrl zaradi možganske krvavitve, ki jo je najverjetneje povzročilo sočasno uživanje lecanemaba in zdravila za redčenje krvi, čeprav proizvajalec vzročno povezavo zanika.
Poleg smrti ima lecanemab druge resne stranske učinke, denimo otekanje možganov in krvavitve. Tako imenovani ARIA (amyloid-related imaging abnormalities) se je pojavil pri 21 odstotkih bolnikov, ki so prejemali zdravilo. Številni bolniki z Alzheimerjevo boleznijo imajo tudi cerebralno amiloidno angiopatijo, kjer amiloidni skupki počasni nadomeščajo normalno tkivo žilnih sten. Ti so še posebej ogroženi, če uživajo lecanemab. V kliničnem preizkusu je moralo sedem odstotkov ljudi prenehati jemati zdravilo, ker so se pojavili hudi stranski učinki, tudi možganske krvavitve in otekanje.
A po drugi strani zaradi Alzheimerjeve bolezni trpi 55 milijonov ljudi na svetu, do leta 2050 pa naj bi jih bilo več kot 139 milijonov. Že samo upočasnitev napredka bolezni bi milijonom ljudi podarila mesece ali leta boljšega življenja. Pomembno bi vplivala tudi na njihove skrbnike, saj Alzheimerjeva bolezen prizadene tudi bližnje in konec koncev zdravstvenemu sistemu in družbi povzroča velikanske stroške. Toda hudi stranski učinki pomenijo, da bo predpisovanje zdravila, če bo sploh potrjeno, bržkone zelo restriktivno. Napadanje skupkov proteina amiloid beta ni nujno celotna zgodba, saj pri razvoju bolezni sodelujejo tudi druge poti. Protein tau je še eden izmed krivcev, ki se lahko napačno zvije in postane netopen, kar spet povzroča nevrološke simptome.
Zaradi navedenega je zdravilo za Alzheimerjevo bolezen zelo zaželeno in pogosto predmet sporov. Lani je FDA odobril podobno zdravilo aducanumab, čeprav klinične študije niso bile enoznačno pozitivne. Strokovna komisija je odobritev tedaj odsvetovala, zato so nekateri člani odbora po odobritvi protestno odstopili. FDA sicer ni treba upoštevati mnenja strokovne komisije, a to običajno stori. In da, tudi aducanumab je razvilo isto podjetje - Biogen.