Slo-Tech - Tretji dan razglasitev prejemnikov Nobelovih nagrad je tradicionalno posvečen kemiji. Danes smo tako izvedeli, da so letošnji nagrajenci na področju kemije švicarski biofizik Jacques Dubochet, ameriški biofizik Joachim Frank in škotski fizik Richard Henderson. Nagrado prejmejo za razvoj krioelektronske mikroskopije za določitev strukture biomolekul v raztopinah z visoko ločljivostjo. Letošnji nagrajenci so razvili metodo, s katero lahko danes opazujemo posamezne atome v velikih biomolekulah.
Struktura biomolekul je izjemno pomembna, ker je od nje odvisna njihova funkcija. Zato ni presenetljivo, da je bilo podeljenih že precej Nobelovih nagrad za tehnike, ki nam pomagajo opazovati strukturo biomolekul. Nobelove nagrade za kemijo v letih 1982, 1985, 1987 in 2002 so pripoznale razvoj na področju določanje strukture biomolekul, nagrade v letih 1958, 1962, 1964, 1972, 1988 in 2009 pa za uporabo struktur pri določanju funkcij biomolekul.
Pri določanju strukture je lepo, če je temperatura čim nižja, da so molekule stabilne. Problem pa predstavlja voda, ki je univerzalno topilo za življenje, saj se te molekule navadno nahajajo v vodnih raztopinah. Strukturo kristaliziranih molekul lahko dobro določimo z rentgensko difrakcijo, a v kristalu imajo molekule gotovo vsaj malo drugačno strukturo kako v vodnih raztopinah. Tudi rentgenska difrakcija je seveda zelo uporabna, saj so na primer prav z njo določiti strukturo DNK, a kaj ko vse molekule ne tvorijo lepih kristalov. Danes želimo z biološkimi makromolekulami še več. Slednjih pa ne moremo preveč ohladiti, saj voda zmrzne v kristalinični led, ki moti določitve strukture biomolekul.
Poleg rentgenske difrakcije, ki je odlična za analizo strukture kristaliničnih, dobro definiranih vzorcev, je zelo uporabna tudi jedrska magnetna resonanca (NMR). Pri tej tehniki molekule raztopino v težki vodi ali kakšnem drugem devteriranem topilu (ker devterij za razliko od vodika ni aktiven v protonskem NMR), potem pa v močnem magnetnem polju preklapljamo spine atomov in opazujemo njihovo relaksacijo. Iz tega podatkov dobimo zelo dobro informacijo o strukturi molekule. Problem pa je, da je NMR precej kompleksna tehnika, ki dobro deluje le za sorazmerno majhne vzorce. Z njo lahko določimo strukturo oligonukleotida DNK ali manjšega proteina, medtem ko virusa zika na ta način gotovo ne bomo analizirali. Signal je namreč preveč kompleksen. Zato potrebujemo elektronsko mikroskopijo.
Molekule lahko gledamo z elektronsko mikroskopijo, ki deluje podobno kot navadna mikroskopija, le da namesto svetlobe (fotonov) uporabljamo elektrone, s katerimi tipamo vzorec. Ti imajo bistveno krajšo valovno dolžino, zato lahko opazujemo nadrobnosti, kot so atomi. Glavni problem je, da so elektroni precej energetski, zato morajo molekule preživeti obstreljevanje z elektroni, da si jih lahko na ta način ogledujemo. Še prej pa se moramo rešiti ledu, kar je dosegla letošnja trojica nagrajencev. Razvili so krioelektronsko mikroskopijo, pri kateri vzorec hitro zmrznemo. Če kapljico vode z biološkimi makromolekulami izstrelimo v ohlajen etan na -196 °C, bo zmrznila tako hitro, da ne bo nastal kristalinični led, temveč bo voda zmrznila v amorfen, steklast led. Na ta način lahko posnamemo fotografije posameznih proteinov, virusov in podobno v vodni raztopini.
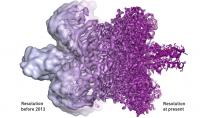
Zametki tehnologije so v 70. letih, ko je bil v Nature objavljen posnetek bakteriorodopsina, ki ga je pripravil Henderson. Toda ločljivost tega posnetka je bila okrog 7 Å, kar je preveč. Tipične vezi v molekulah namreč merijo 1-2 Å, zato s 7 Å posameznih atomov ne moremo razločiti. Šele v 90. letih je tehnologija dovolj napredovala, da smo dobili prve posnetke z ločljivostjo atoma. Toda bakteriorodopsin je posebna makromolekula, ker je na membrani več molekul, ki so vse obrnjene v isto smer. Tak vzorec je hvaležen za obdelavo. Lahko ga presvetlimo s šibkim curkom elektronov, saj bi ga močan prežgal, potem pa izračunamo strukturo, ker imamo v vzorcu mnogo enako orientiranih molekul. Mimogrede, bakteriorodopsin je prisoten v nekaterih arhejah, zaradi katerih so nekatera jezera vijoličasta. Kaj pa z ostalimi vzorci, kjer so molekule razmetane in obrnjene naključno? Številni so menili, da je to nemogoče, a pokazalo se je, da gre.
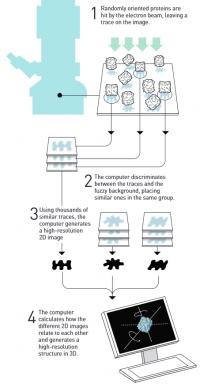
Frank se je ukvarjal prav s tem problemom in leta 1975 objavil teoretično strategijo, kako bi se problema lotil. Več dvodimenzionalnih slik iz mikroskopa bi namreč z računalnikom lahko sestavil v tridimenzionalno sliko. Dobro desetletje pozneje mu je to tudi uspelo. Leta 1981 je razvil matematično metodo, s katero je računalnik iz ozadja, polnega šuma, razločil ponavljajoče vzorce in izdelal dvodimenzionalno sliko vzorca. Leta 1985 je potem razvil še metodo, kako te dvorazsežne posnetke zložiti v tridimenzionalno fotografijo. Sredi 80. let je tako posnel ribosom.
Dubochet pa se je medtem ukvarjal s praktičnim problemom snemanja, saj v elektronskem mikroskopu hitro odhlapeva voda. Nekatere vzorce je posnel v raztopini glukoze, za vse pa to ni šlo. Lahko jih je zamrznil, s čimer je problem le spremenil. Led odhlapeva bistveno počasneje, a njegovi kristali sliko uničijo. Zato je začel iskati način, kako vodo zmrzniti v amorfni led. Najprej so poizkusili zmrzovati v tekočem dušiku, kar je vedno prva misel pri delu z nizkimi temperaturami, a ni šlo. Šele ko so uporabili s tekočim dušikom ohlajen etan, je bil rezultat tu. Leta 1982 je Dubochet metodo že izpolnil, leta 1984 pa objavil prve posnetke virusov v amorfnem ledu.
Danes elektronska mikroskopija in krioskopsko zamrzovanje vzorcev ponujata zrelo orodje, s katerim lahko preverimo strukturo makromolekul z natančnostjo atomov ali bolje. In od te metode si v prihajajoči dobi biotehnologije obetamo ogromno.